IVDR (EU) 2017/746 新要求概要:
一、IVDR新要求背景
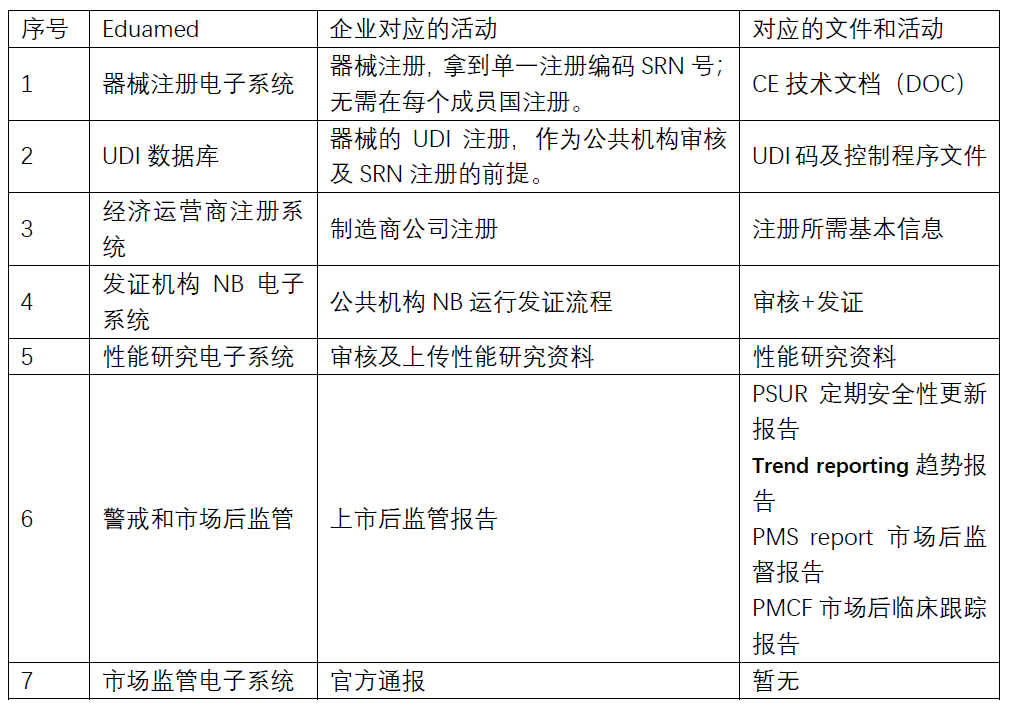
新的IVDR將于2022年5月4日起強制執行。要求最終由歐洲醫療器械電子注冊系統Eudamed來實現。Eudamed包括以下電子系統:
① 器械注冊電子系統
② UDI數據庫
③ 經濟運營商備案登記電子系統
④ 公告機構和證書電子系統
⑤ 性能研究電子系統
⑥ 警戒和上市后監管電子系統
⑦ 市場監管電子系統
該系統涉及的對應企業功能如下:
二、IVDR新要求內容
1 CE技術文檔
使用國際公認的醫療器械命名
參考附錄II技術文件
新涵蓋UDI 編碼文件
風險系統文件
性能評估和和上市后跟蹤文件(PMPF)
CE技術文檔A部分上報后獲得單一注冊號SRN
2 UDI 技術文檔
DI 器械標識
PI生產標識
UDI-DI部分要提交于系統和給NB機構。上市后監管和不良事件處理都要涉及UDI。UDI在UDI數據庫注冊后獲得注冊號。UDI還要體現在自由銷售證書FSC和CE自我申明DoC中。
3 企業文檔
涉及企業注冊各種報表填寫,具體由官方數據庫規定。一般來說跟CE技術文檔的A部分類似。
4質量管理體系
(a) 法規符合性戰略,包括符合性評估流程的遵守和系統所涵蓋的器械的變更管理;
(b) 確定適用的通用安全與性能要求,尋找滿足這些要求的選項;
(c) 管理責任;
(d) 資源管理,包括選擇和管理供應商和分包商;
(e) 附錄I第3節規定的風險管理;
(f) 性能評估,根據第56條和附錄XIII的規定,包括上市后的性能追蹤;
(g) 產品實現規劃,包括規劃、設計、研發、生產和服務提供;
(h) 根據第24(3)條為所有相關器械的UDI分配驗證,并確保根據第26條提供的信息的一致性和有效性;
(i) 根據第78條的要求,建立、實施和維護上市后監管體系;
(j) 與主管機構、公告機構、其他經濟運營商、客戶和/或其他利益相關人溝通;
(k) 警戒情況下的嚴重事件和現場安全糾正措施的報告流程;
(l) 糾正措施和預防措施的管理及其有效性的驗證;
(m) 產品,數據分析和產品改進的監督和評估流程。
5風險管理體系
風險評估中應包含:技術更新風險評估,現場安全糾正措施風險評估,臨床效益風險評估。
有貫穿整個生命周期的風險管理體系。風險管理建立后第一年更新,隨后每兩年一更新。要符合持續合規。
6上市后監管體系
上市后監管計劃
涵蓋:
警戒系統
技術升級風險評估
現場通告,現場糾正措施
主動收集售后投訴和舉報
臨床風險跟蹤措施,PMPF(上市后性能跟蹤)
性能評估
不合格召回
7倫理審批
A,B類器械不需要到歐盟做臨床性能評估,C,D類需要去歐盟做臨床性能評估。
剩余樣本臨床性能評估計劃無須歐盟審批,但需要倫理審批。需要滿足《赫爾辛基宣言》。臨床計劃應符合ISO14155.
8研究計劃
C,D類在歐盟參考實驗室依據CS做性能評估(分析,診斷靈敏度等項目)是臨床研究的前提。
需要提交研究計劃到歐盟數據庫,剩余樣本研究不需要審批,但研究計劃更改和變更需要審批。臨床研究結束后或暫停后三個月內需要提交結果總結,研究報告。
9臨床證據
包含:
性能評估(分析性能+臨床性能)
科學數據(技術文件)
臨床性能(需驗證交叉,干擾)
PMPF(上市后性能追蹤)
效益風險評估
10 PSUR(定期安全性更新報告)
C類和D類器械的制造商應編制定期安全性更新報告(“PSUR”)
PSUR應列出:
(a) 效益風險監測的結論;
(b) 上市后性能跟蹤報告(PMPF)的主要結果;以及
(c) 器械的銷售量和使用器械的群體規模與其他特性的評估,以及實際運行時器械的使用頻率。
C類和D類器械的制造商應至少每年對PSUR進行更新。PSUR應屬于附錄II和III中所規定技術文件中的一部分。
C類器械制造商應向參與符合性評估的公告機構提交PSUR,并應主管機構要求向其提供報告
嚴重事件和現場安全糾正措施的報告和現場安全通告,以及提供定期匯總報告、上市后監管報告、定期安全性更新報告(PSUR)以及趨勢報告;
11趨勢報告
向相關主管機構報告以下內容:
(a) 任何涉及在歐盟市場上所提供器械的嚴重事件,除了在產品信息和技術文件中清楚記錄并量化的預期錯誤結果,此類事件應根據第83條進行趨勢報告
(b) 報告現場安全糾正措施、制造商提供定期匯總報告和趨勢報告的時間表;
12 PMPF
上市后性能追蹤(PMPF)
參見附錄XIII 性能評估、性能研究和上市后跟蹤(PMPF)
PMPF計劃應至少包括:
(a) 應用PMPF的一般方法和流程,如收集獲得的臨床經驗、使用者反饋、科學文獻篩選和其他性能或科學數據來源;
(b) 應用PMPF的具體方法和流程(例如,環形比對試驗和其他質量保證活動、流行病學研究、合適的患者評估或疾病登記、遺傳數據庫或上市后臨床性能研究);
(c) (a)和(b)中所述的方法和流程適當性的理由;
(d) 參考本附錄A部分第1.3節所所述的性能評估報告的相關部分以及附錄I
第3節所述的風險管理;
(e) PMPF要解決的具體目標;
(f) 與等效或類似器械相關的性能數據評估,以及技術發展最新水平;
(g) 參考制造商使用的所有CS、協調標準和相關PMPF指南;
(h) 由制造商進行的PMPF活動的詳細且充分合理的時間表(例如,PMPF數據和報告分析)。
13不良事件報告
UDI用于報告嚴重不良事件及現場安全糾正措施
臨床性能研究生成唯一的標識號用于報告嚴重不良事件及現場安全糾正措施
性能研究中:申辦方應充分記錄以下所有情況:
(a) 在性能研究計劃中發現對性能研究結果的評估至關重要的任何不良事件類型;
(b) 任何嚴重不良事件;
(c) 任何如未采取適當措施、未發生干預或情況不利時,可能導致嚴重不良事件的器械缺陷;
14 CE證書的簽發
D類器械由NB審批+政府審批。D類器械實行批批簽
B,C類器械由NB審核發證。
D類器械由歐盟參考實驗室進行性能驗證
性能驗證涵蓋(分析性能+安全性能)分析性能驗證計劃需涵蓋:原理,目的,方法,檢測,統計,并可執行。
B,C類器械由通告機構驗證
A類企業自行驗證
B類技術文件的審批參照附錄IX 4.4-4.8和附錄I和附錄II。涵蓋:CS,協調標準,性能評估,溯源,培訓,PMPF,風險,警戒等。
加強質量管理體系飛行檢查。
B,C類需要審核《趨勢報告》
證書提交于證書系統數據庫。
CE證書是準許上市和獲得FSC的前提。
15 自由銷售證書FSC
自由銷售證書應列明器械基本UDI-DI。自由銷售證書應列出公告機構簽發的唯一識別號以標識此證書。自由銷售證書,應制造商或授權代表要求,制造商或授權代表注冊地所在成員國需簽發一份自由銷售證書。
16 分類規則
參考附錄VIII
規則1
用于以下用途的器械歸類為D類:
- 檢測血液、血液成分、細胞、組織或器官,或其任何衍生物是否存在或顯露傳染性因子,以評估它們是否適用于輸血、器官移植或細胞給藥。
- 檢測是否存在或顯露傳染性因子,其會導致危及生命的疾病,并且具有高的或可疑的傳播風險。-確定危及生命的疾病的病原體載量,其監控對于患者管理的過程十分關鍵。
規則2
器械預期用于血型分型或組織分型,以確保用于輸血或移植或細胞給藥的血液、血液成分、細胞、組織或器官具有免疫相容性,此類器械歸類為C類,但用于確定以下任何標記物的器械除外:
- ABO系統 [A(ABO1)、B(ABO2)、AB(ABO 3)];
- 恒河猴(Rhesus)系統 [RH1(D)、RHW1、RH2(C)、RH3(E)、RH4(C)、RH5(E)];
- KELL系統 [Kel1(K)];
- KIDD系統 [JK1(JKA)、JK2(JKB)];
- DUFFY系統 [FY1(FYA)、FY2(FYB)],
在這種情況下,它們被歸為D類。
規則3
器械被歸為C類,若其目的是:
(a) 用于檢測是否存在或顯露性傳播病原體的;
(b) 用于檢測是否在腦脊液或血液中存在某種高的或可疑的高傳播風險的病原體;
(c) 用于檢測病原體的存在,其報告結果若錯誤可帶來引起個人、胎兒、胚胎或個體的后代死亡或嚴重殘疾的重大風險;
(d) 用于女性的產前篩查,確定其對感染原的免疫狀況;
(e) 用于確定感染性疾病的狀態或免疫狀態,若其報告結果將會引起患者治療決定導致危及患者或患者后代生命的風險;
(f) 用作伴隨診斷;
(g) 用于疾病分期,若其報告結果錯誤將會引起患者治療決定導致危及患者或患者后代生命風險的;
(h) 用于癌癥的篩查、診斷或分期;
(i) 人類基因檢測;
(j) 用于檢測藥用產品、物質或生物組分的水平,若其報告結果錯誤將會引起患者治療決定導致危及患者后代生命的風險;
(k) 對危及生命的疾病或病癥患者,進行患者管理;
(l) 用于篩查胚胎或胎兒的先天性疾病;
(m) 用于新生兒的先天性疾病篩查,未能檢測和治療這些疾病可能導致危及生命的情況或嚴重殘疾。
規則4
(a) 自測器械歸為C類,但用于妊娠檢測、生育力測試、確定膽固醇濃度以及檢測葡萄糖、紅細胞、白細胞和尿樣本中細菌的器械除外,這些器械歸為B類。
(b) 床旁檢測器械根據其本身特性進行分類。
規則5
以下器械歸為A類:
(a) 一般實驗室使用的產品、沒有危險特征的附件、緩沖液、洗滌液、一般培養基和組織學染色液,制造商使其適用于相關某一特定檢查的體外診斷流程;
(b) 制造商專門用于體外診斷流程的器械;
(c) 樣品容器。
規則6
上述分類規則未涵蓋的器械歸類為B類。
規則7
不具有定量或定性賦值的質控品的器械歸類為B類。


 掃一掃添加微信
掃一掃添加微信